Đề thi giữa kì 1 Hóa 9 - Đề số 5
Tổng hợp đề thi học kì 2 lớp 9 tất cả các môn
Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa - GDCD
Đề bài
Dãy muối cacbonat bị nhiệt phân ở nhiệt độ cao
-
A.
Na2CO3, Ca(HCO3)2.
-
B.
K2CO3, KHCO3.
-
C.
CaCO3, Ca(HCO3)2.
-
D.
MgCO3, K2CO3.
Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là:
-
A.
Có bọt khí thoát ra, dung dịch thu được không màu
-
B.
Có xuất hiện kết tủa trắng
-
C.
Dung dịch đổi màu vàng nâu
-
D.
Không có hiện tượng gì xảy ra
Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây?
-
A.
Na2SO3 và H2O
-
B.
Na2SO3 và NaOH
-
C.
Na2SO4 và HCl
-
D.
Na2SO3 và H2SO4
Kim loại nào sau đây có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí?
-
A.
Al
-
B.
Fe
-
C.
Ca
-
D.
Na
Kim loại vonfam được dùng làm dây tóc bóng đèn vì những nguyên nhân nào sau đây?
-
A.
Là kim loại rất cứng
-
B.
Là kim loại rất mềm
-
C.
Là kim loại có nhiệt độ nóng chảy rất cao
-
D.
Là kim loại có khối lượng phân tử lớn.
Gang là hợp kim của sắt với cacbon và một lượng nhỏ các nguyên tố khác như: Si, Mn, S,… trong đó hàm lượng cacbon chiếm:
-
A.
Từ 2% đến 6%
-
B.
Dưới 2%
-
C.
Từ 2% đến 5%
-
D.
Trên 6%
Nhóm kim loại nào có thể tác dụng với nước ở nhiệt độ thường:
-
A.
Cu, Ca, K, Ba
-
B.
Zn, Li, Na, Cu
-
C.
Ca, Mg, Li, Zn
-
D.
K, Na, Ca, Ba
Phản ứng hoá học nào sau đây tạo ra oxit bazơ ?
-
A.
Cho dd Ca(OH)2 dư phản ứng với SO2
-
B.
Cho dd NaOH phản ứng với dd H2SO4
-
C.
Cho Cu(OH)2 phản ứng với HCl
-
D.
Nung nóng Cu(OH)2
Trong các kim loại sau: Cu, Fe, Pb, Al người ta thường dùng kim loại nào để làm vật liệu dẫn điện hay dẫn nhiệt?
-
A.
Chỉ có Cu
-
B.
Cu và Al
-
C.
Fe và Al
-
D.
Chỉ có Al
Tính chất vật lí nào sau đây của sắt khác với các kim loại khác?
-
A.
Dẫn nhiệt
-
B.
Tính nhiễm từ
-
C.
Dẫn điện
-
D.
Ánh kim
Quặng nào sau đây chứa thành phần chính là Al2O3:
-
A.
Boxit.
-
B.
Pirit.
-
C.
Đolomit.
-
D.
Apatit.
Trong các oxit sau, oxit nào tác dụng được với nước?
-
A.
CaO ;
-
B.
CuO ;
-
C.
Fe2O3 ;
-
D.
ZnO.
Có thể dung CaO để làm khô khí nào trong các khí dưới đây:
-
A.
CO2
-
B.
SO2
-
C.
CO
-
D.
SO3
Nhôm bền trong không khí là do
-
A.
nhôm nhẹ, có nhiệt độ nóng chảy cao.
-
B.
nhôm không tác dụng với nước.
-
C.
nhôm không tác dụng với oxi.
-
D.
có lớp nhôm oxit mỏng bảo vệ.
Dãy A gồm các dung dịch : NaOH, HCl, H2SO4; Dãy B gồm các dung dịch: CuSO4, BaCl2, AgNO3.
Cho lần lượt các chất ở dãy A phản ứng đôi một với các chất ở dãy B. Số phản ứng thu xảy ra thu được kết tủa là:
-
A.
4
-
B.
5
-
C.
6
-
D.
3
Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
-
A.
CaCO3.
-
B.
MgCO3.
-
C.
NaCl.
-
D.
CaO.
Nhiệt phân sắt (III) hiđroxit thu được sản phẩm là:
-
A.
Fe2O3.
-
B.
Fe.
-
C.
Fe2O3 và H2O.
-
D.
Fe và H2O.
Trong các loại phân bón sau, phân bón hoá học kép là:
-
A.
(NH4)2SO4
-
B.
Ca(H2PO4)2
-
C.
KCl
-
D.
KNO3
Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
-
A.
Al.
-
B.
Fe.
-
C.
Mg.
-
D.
Cu.
Dung dịch có độ bazơ mạnh nhất trong các dung dịch có giá trị pH sau:
-
A.
pH = 8
-
B.
pH = 12
-
C.
pH = 10
-
D.
pH = 14
Một oxit được tạo bởi 2 nguyên tố là sắt và oxi, trong đó tỉ lệ khối lượng giữa sắt và oxi là 7/3. Công thức hoá học của oxit sắt là:
-
A.
FeO.
-
B.
Fe2O3.
-
C.
Fe3O4.
-
D.
FeO2.
Khối lượng Al2O3 phản ứng vừa hết với 200 ml dung dịch KOH 1M là:
-
A.
5,1 gam.
-
B.
10,2 gam
-
C.
17,1 gam.
-
D.
7,8 gam.
Dẫn 1,12 lít khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M. Khối lượng của muối thu được sau phản ứng là
-
A.
8 gam.
-
B.
12 gam.
-
C.
6 gam.
-
D.
9 gam.
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
-
A.
44,8 lít
-
B.
4,48 lít
-
C.
2,24 lít
-
D.
22,4 lít
Cho 8 gam Mg, Al vào dung dịch \(HCl\) vừa đủ. Sau phản ứng thu được dung dịch X, 2,36 (g) chất rắn và 6,272 (l) khí ở đktc. Phần trăm khối lượng mỗi kim loại có trong hỗn hợp lần lượt là.
-
A.
40% và 60%.
-
B.
60% và 40%.
-
C.
30% và 70%.
-
D.
70% và 30%.
Thêm 250 ml dung dịch NaOH 2M vào 200 ml dung dịch H3PO4 1,5M. Muối tạo thành và khối lượng tương ứng là:
-
A.
14,2 gam Na2HPO4; 32,8 gam Na3PO4
-
B.
28,4 gam Na2HPO4; 16,4 gam Na3PO4
-
C.
12,0 gam NaH2PO4; 28,4 gam Na2HPO4
-
D.
24,0 gam NaH2PO4; 14,2 gam Na2HPO4
Thành phần phần trăm của Na và Ca trong hợp chất NaOH và Ca(OH)2 lần lượt là:
-
A.
50% và 54%
-
B.
52% và 56%
-
C.
54,1% và 57,5%
-
D.
57,5% và 54,1%
Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
-
A.
29,58% và 70,42%
-
B.
70,42% và 29,58%
-
C.
65% và 35%
-
D.
35% và 65%
Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
-
A.
2,24 lít
-
B.
4,48 lít
-
C.
22,4 lít
-
D.
44,8 lít
Khi làm nguội 1026,4 gam dung dịch bão hòa R2SO4. nH2O (trong đó R là kim loại kiềm và n nguyên, thỏa mãn điều kiện 7< n< 12) từ 800C xuống 100C thì có 395,4 gam tinh thể R2SO4. nH2O tách ra khỏi dung dịch. Biết độ tan của R2SO4 ở 800C và 100C lần lượt là 28,3 gam và 9 gam. Công thức phân tử của hiđrat nói trên là:
-
A.
Cu
-
B.
Na
-
C.
Al
-
D.
K
Một loại phân dùng để bón cho cây được một người sử dụng với khối lượng là 500 gam, phân này có thành phần hóa học là (NH4)2SO4. Cho các phát biểu sau về loại phân bón trên:
(1) Loại phân này được người đó sử dụng nhằm cung cấp đạm và lân cho cây.
(2) Thành phần phần trăm nguyên tố dinh dưỡng có trong 200 gam phân bón trên là 21,21%
(3) Khối lượng của nguyên tố dinh dưỡng có trong 500 gam phân bón trên là 106,06 gam.
(4) Loại phân này khi hòa tan vào nước thì chỉ thấy một phần nhỏ phân bị tan ra, phần còn lại ở dạng rắn dẻo.
(5) Nếu thay 500 gam phân urê bằng 500 gam phân bón trên thì sẽ có lợi hơn.
Số phát biểu đúng là
-
A.
5
-
B.
4
-
C.
3
-
D.
2
Biết khối lượng riêng của nhôm là 2,7g/cm3. Vậy thể tích 1 mol của nhôm là:
-
A.
2,7gam
-
B.
10cm3
-
C.
27gam
-
D.
100cm3
Hòa tan 5,1g oxit của một kim loại hóa trị III bằng dung dịch HCl, số mol axit cần dùng là 0,3 mol. Công thức phân tử của oxit đó là :
-
A.
Fe2O3
-
B.
Al2O3
-
C.
Cr2O3
-
D.
FeO
Cho 5,4 gam bột nhôm vào 200 ml dung dịch NaOH, sau phản ứng thấy khối lượng dung dịch tăng 3,6 gam. Nồng độ mol/lít của dung dịch NaOH là
-
A.
0,45M.
-
B.
1,00M.
-
C.
0,75M.
-
D.
0,50M.
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là
-
A.
0,3 mol.
-
B.
0,6 mol.
-
C.
0,4 mol.
-
D.
0,25 mol.
Cho 11,2 gam kim loại sắt tác dụng hết với dd H2SO4 loãng, thể tích khí H2 thu được ở đktc là
-
A.
2,24 lít.
-
B.
3,36 lít.
-
C.
6,72 lít.
-
D.
4,48 lít.
Cho dung dịch AgNO3 dư tác dụng với hỗn hợp có hòa tan 12,5 gam hai muối KCl và KBr thu được 20,78 gam hỗn hợp AgCl và AgBr. Thành phần % của muối AgCl trong hỗn hợp thu được sau phản ứng là.
-
A.
76,22%
-
B.
67,26%
-
C.
22,67%
-
D.
27,62%
Hòa tan 7,74 gam hỗn hợp 2 kim loại Mg, Al trong 500ml dung dịch hỗn hợp chứa HCl 1M và H2SO4 0,38M loãng. Thu được dung dịch A và 8,736 lít khí H2 (đktc). Khối lượng muối có trong dung dịch A là
-
A.
38 gam
-
B.
40 gam
-
C.
42 gam
-
D.
36 gam
Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
-
A.
Kim loại R không tan được trong nước ở điều kiện thường.
-
B.
Kim loại R khi phản ứng với lưu huỳnh sẽ tạo ra chất rắn có màu đen.
-
C.
Giá trị của V là 1,12.
-
D.
Thành phần phần trăm về khối lượng của R (hóa trị II) trong hợp chất muối sunfat ứng với R là 28%.
Tiến hành hai thí nghiệm:
-Thí nghiệm 1: Cho 650 ml dung dịch NaOH 2M vào 400 ml dung dịch AlCl3 aM thu được 3b gam kết tủa.
-Thí nghiệm 2: Cho 700 ml dung dịch NaOH 2M vào 400 ml dung dịch AlCl3 aM thu được 2b gam kết tủa.
Giá trị của a, b là:
-
A.
a=1(M); b = 15,6(g)
-
B.
a=2(M); b = 7,8(g)
-
C.
a=2(M); b = 15,6(g)
-
D.
a=1(M); b = 7,8(g)
Lời giải và đáp án
Dãy muối cacbonat bị nhiệt phân ở nhiệt độ cao
-
A.
Na2CO3, Ca(HCO3)2.
-
B.
K2CO3, KHCO3.
-
C.
CaCO3, Ca(HCO3)2.
-
D.
MgCO3, K2CO3.
Đáp án : C
Ghi nhớ: Na2CO3 và K2CO3 không bị nhiệt phân hủy
=> loại A, B, D => Chọn C
CaCO3 \(\xrightarrow{{{t^0}}}\) CaO + CO2↑
Ca(HCO3)2 \(\xrightarrow{{{t^0}}}\) CaCO3 + CO2 + H2O
Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là:
-
A.
Có bọt khí thoát ra, dung dịch thu được không màu
-
B.
Có xuất hiện kết tủa trắng
-
C.
Dung dịch đổi màu vàng nâu
-
D.
Không có hiện tượng gì xảy ra
Đáp án : B
Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là: Có xuất hiện kết tủa trắng
AgNO3 + NaCl → AgCl(↓ trắng) + NaNO3
Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây?
-
A.
Na2SO3 và H2O
-
B.
Na2SO3 và NaOH
-
C.
Na2SO4 và HCl
-
D.
Na2SO3 và H2SO4
Đáp án : D
Công thức hóa học của lưu huỳnh đioxit là SO2
A, B, C đều không xảy ra phản ứng hóa học
D. Na2SO3 + 2H2SO4 → Na2SO4 + SO2↑ + H2O
Kim loại nào sau đây có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí?
-
A.
Al
-
B.
Fe
-
C.
Ca
-
D.
Na
Đáp án : A
Cần nắm được tính chất hóa học của kim loại tác dụng với oxi trong không khí
Kim loại có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí là Al. Al trong không khí thường có lớp màng oxit Al2O3 bảo vệ.
Kim loại vonfam được dùng làm dây tóc bóng đèn vì những nguyên nhân nào sau đây?
-
A.
Là kim loại rất cứng
-
B.
Là kim loại rất mềm
-
C.
Là kim loại có nhiệt độ nóng chảy rất cao
-
D.
Là kim loại có khối lượng phân tử lớn.
Đáp án : C
Kim loại vonfam được dùng làm dây tóc bóng đèn vì Là kim loại có nhiệt độ nóng chảy rất cao
Gang là hợp kim của sắt với cacbon và một lượng nhỏ các nguyên tố khác như: Si, Mn, S,… trong đó hàm lượng cacbon chiếm:
-
A.
Từ 2% đến 6%
-
B.
Dưới 2%
-
C.
Từ 2% đến 5%
-
D.
Trên 6%
Đáp án : C
Từ 0,01 – 2% khối lượng C là thép và từ 2 – 5% khối lượng C là gang
Nhóm kim loại nào có thể tác dụng với nước ở nhiệt độ thường:
-
A.
Cu, Ca, K, Ba
-
B.
Zn, Li, Na, Cu
-
C.
Ca, Mg, Li, Zn
-
D.
K, Na, Ca, Ba
Đáp án : D
Nhóm kim loại tác dụng với nước ở nhiệt độ thường là: K, Na, Ca, Ba
Phản ứng hoá học nào sau đây tạo ra oxit bazơ ?
-
A.
Cho dd Ca(OH)2 dư phản ứng với SO2
-
B.
Cho dd NaOH phản ứng với dd H2SO4
-
C.
Cho Cu(OH)2 phản ứng với HCl
-
D.
Nung nóng Cu(OH)2
Đáp án : D
A. Cho dd Ca(OH)2 phản ứng với SO2
Ca(OH)2 + SO2 → CaSO3 + H2O
=> không tạo ra oxit bazơ
B. Cho dd NaOH phản ứng với dd H2SO4
2NaOH + H2SO4 → Na2SO4 + H2O
=> không tạo ra oxit bazơ
C. Cho Cu(OH)2 phản ứng với HCl
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
=> không tạo ra oxit bazơ
D. Nung nóng Cu(OH)2
Cu(OH)2 $\xrightarrow{{{t}^{o}}}$ CuO + H2O
=> tạo ra oxit bazơ là CuO
Trong các kim loại sau: Cu, Fe, Pb, Al người ta thường dùng kim loại nào để làm vật liệu dẫn điện hay dẫn nhiệt?
-
A.
Chỉ có Cu
-
B.
Cu và Al
-
C.
Fe và Al
-
D.
Chỉ có Al
Đáp án : B
Trong thực tế người ta thường sử dụng 2 kim loại để làm vật liệu dẫn điện và dẫn nhiệt là Cu và Al.
Tính chất vật lí nào sau đây của sắt khác với các kim loại khác?
-
A.
Dẫn nhiệt
-
B.
Tính nhiễm từ
-
C.
Dẫn điện
-
D.
Ánh kim
Đáp án : B
Tính chất vật lí của sắt khác với các kim loại khác là: tính nhiễm từ
Quặng nào sau đây chứa thành phần chính là Al2O3:
-
A.
Boxit.
-
B.
Pirit.
-
C.
Đolomit.
-
D.
Apatit.
Đáp án : A
Ghi nhớ phản ứng điều chế Al trong công nghiệp
Thành phần chính của quặng boxit là Al2O3
Thành phần chính của quặng Pirit là FeS2
Thành phần chính của quặng Đolomit là: MgCO3. CaCO3
Thành phần chính của quặng Apatit là: Ca3(PO4)2
Trong các oxit sau, oxit nào tác dụng được với nước?
-
A.
CaO ;
-
B.
CuO ;
-
C.
Fe2O3 ;
-
D.
ZnO.
Đáp án : A
Ghi nhớ: oxit của kim loại kiềm, kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường.
CaO + H2O → Ca(OH)2
Có thể dung CaO để làm khô khí nào trong các khí dưới đây:
-
A.
CO2
-
B.
SO2
-
C.
CO
-
D.
SO3
Đáp án : C
CaO không tác dụng với CO nên có thể dung để làm khô khí CO
Nhôm bền trong không khí là do
-
A.
nhôm nhẹ, có nhiệt độ nóng chảy cao.
-
B.
nhôm không tác dụng với nước.
-
C.
nhôm không tác dụng với oxi.
-
D.
có lớp nhôm oxit mỏng bảo vệ.
Đáp án : D
Dựa vào tính chất hóa học của nhôm: tác dụng với phi kim
Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước
Dãy A gồm các dung dịch : NaOH, HCl, H2SO4; Dãy B gồm các dung dịch: CuSO4, BaCl2, AgNO3.
Cho lần lượt các chất ở dãy A phản ứng đôi một với các chất ở dãy B. Số phản ứng thu xảy ra thu được kết tủa là:
-
A.
4
-
B.
5
-
C.
6
-
D.
3
Đáp án : B
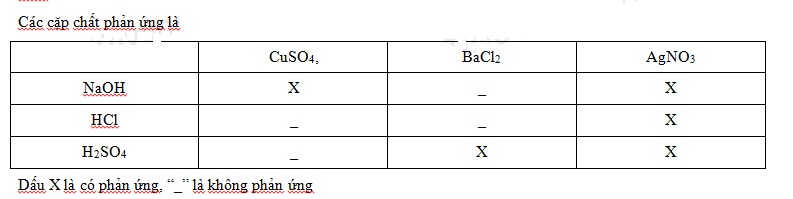
Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
-
A.
CaCO3.
-
B.
MgCO3.
-
C.
NaCl.
-
D.
CaO.
Đáp án : D
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazơ để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazơ)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Nhiệt phân sắt (III) hiđroxit thu được sản phẩm là:
-
A.
Fe2O3.
-
B.
Fe.
-
C.
Fe2O3 và H2O.
-
D.
Fe và H2O.
Đáp án : C
Bazo không tan nhiệt phân tạo thành oxit tương ứng và nước
2Fe(OH)3 \(\buildrel {{t^0}} \over\longrightarrow \)Fe2O3 + 3H2O
Trong các loại phân bón sau, phân bón hoá học kép là:
-
A.
(NH4)2SO4
-
B.
Ca(H2PO4)2
-
C.
KCl
-
D.
KNO3
Đáp án : D
Phân bón hoá học kép là phân bón có chứa 2, 3 nguyên tố N, P, K: KNO3
Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
-
A.
Al.
-
B.
Fe.
-
C.
Mg.
-
D.
Cu.
Đáp án : D
HCl chỉ tác dụng được với các kim loại đứng trước H trong dãy điện hóa của kim loại
Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl => chất rắn T là Cu
Dung dịch có độ bazơ mạnh nhất trong các dung dịch có giá trị pH sau:
-
A.
pH = 8
-
B.
pH = 12
-
C.
pH = 10
-
D.
pH = 14
Đáp án : D
pH > 7: dung dịch có tính bazơ, pH càng lớn độ bazơ càng lớn
=> pH = 14 có độ bazơ mạnh nhất
Một oxit được tạo bởi 2 nguyên tố là sắt và oxi, trong đó tỉ lệ khối lượng giữa sắt và oxi là 7/3. Công thức hoá học của oxit sắt là:
-
A.
FeO.
-
B.
Fe2O3.
-
C.
Fe3O4.
-
D.
FeO2.
Đáp án : B
Tỉ lệ khối lượng giữa Fe và O là 7/3
=> Đặt khối lượng của Fe là 7 thì khối lượng của O là 3
Gọi công thức của oxit là: FexOy (x,y € N*)
Áp dụng công thức ta có:
\(\begin{gathered}
x:y = {n_{Fe}}:{n_O} \hfill \\
\,\,\,\,\,\,\,\,\,\, = \frac{{{m_{Fe}}}}{{56}}:\frac{{{m_O}}}{{16}} \hfill \\
\end{gathered} \)
=> x, y = ?
Tỉ lệ khối lượng giữa Fe và O là 7/3
=> Đặt khối lượng của Fe là 7 thì khối lượng của O là 3
Gọi công thức của oxit là: FexOy (x,y € N*)
Áp dụng công thức ta có:
\(\begin{gathered}
x:y = {n_{Fe}}:{n_O} \hfill \\
\,\,\,\,\,\,\,\,\,\, = \frac{{{m_{Fe}}}}{{56}}:\frac{{{m_O}}}{{16}} \hfill \\
\,\,\,\,\,\,\,\,\,\, = \frac{7}{{56}}:\frac{3}{{16}} \hfill \\
\,\,\,\,\,\,\,\,\,\, = 0,125:0,1875 \hfill \\
\,\,\,\,\,\,\,\,\,\, = 2:3 \hfill \\
\end{gathered} \)
Vậy công thức của oxit là Fe2O3
Khối lượng Al2O3 phản ứng vừa hết với 200 ml dung dịch KOH 1M là:
-
A.
5,1 gam.
-
B.
10,2 gam
-
C.
17,1 gam.
-
D.
7,8 gam.
Đáp án : B
Bước 1: Đổi số mol KOH = VKOH.CM
Bước 2: Tính số mol Al2O3 theo mol KOH dựa vào PTHH: Al2O3 + 2KOH → 2KAlO2 + H2O
200 ml = 0,2 (lít) ⟹ nKOH = V.CM = 0,2.1 = 0,2 (mol)
PTHH: Al2O3 + 2KOH → 2KAlO2 + H2O
(mol) 0,1 ← 0,2
Theo PTHH ta có: nAl2O3 = 1/2 nKOH = 1/2.0,2 = 0,1 (mol)
⟹ mAl2O3 = nAl2O3. MAl2O3 = 0,1.102 = 10,2 (g)
Dẫn 1,12 lít khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M. Khối lượng của muối thu được sau phản ứng là
-
A.
8 gam.
-
B.
12 gam.
-
C.
6 gam.
-
D.
9 gam.
Đáp án : C
+) Xét tỉ lệ: $\dfrac{{{n_{S{O_2}}}}}{{{n_{Ca{{(OH)}_2}}}}}$ => phản ứng tạo muối CaSO3
+) Viết PTHH và tính khối lượng CaSO3 theo SO2
${n_{S{O_2}}} = 0,05{\text{ }}mol;{\text{ }}{n_{Ca{{\left( {OH} \right)}_2}}} = 0,07{\text{ }}mol$
Xét tỉ lệ: $\dfrac{{{n_{S{O_2}}}}}{{{n_{Ca{{(OH)}_2}}}}} = \dfrac{{0,05}}{{0,07}} < 1$ => SO2 hết, Ca(OH)2 dư, phản ứng tạo muối CaSO3
SO2 + Ca(OH)2 → CaSO3 + H2O
0,05 → 0,05 → 0,05
=> mCaSO3 = 0,05.120 = 6 gam
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
-
A.
44,8 lít
-
B.
4,48 lít
-
C.
2,24 lít
-
D.
22,4 lít
Đáp án : B
Đổi số mol của Mg: nMg = mMg : MMg = ? (mol)
Viết PTHH xảy ra: Mg + 2HCl → MgCl2 + H2
Tính số mol của H2 theo số mol của Mg: nH2 = nMg = ? (mol)
=> VH2(đktc) = nH2×22,4 = ? (lít)
nMg = mMg : MMg = 4,8 : 24 = 0,2mol
PTHH: Mg + 2HCl → MgCl2 + H2
1mol 2mol 1mol
0,2mol ? mol
VH2 = nH2 . 22,4 = 0,2 . 22,4 = 4,48l
Cho 8 gam Mg, Al vào dung dịch \(HCl\) vừa đủ. Sau phản ứng thu được dung dịch X, 2,36 (g) chất rắn và 6,272 (l) khí ở đktc. Phần trăm khối lượng mỗi kim loại có trong hỗn hợp lần lượt là.
-
A.
40% và 60%.
-
B.
60% và 40%.
-
C.
30% và 70%.
-
D.
70% và 30%.
Đáp án : C
TH1: Giả sử chỉ có phản ứng, Al chưa phản ứng
TH2: Giả sử có cả Mg và Al đều phản ứng.
Biện luận chất rắn thu được theo tính toán với theo đề bài cho mỗi trường hợp để xem trường hợp nào thỏa mãn.
- Khí tạo thành sau phản ứng là \({H_2}\)
\({n_{{H_2}}} = \frac{{6,272}}{{22,4}} = 0,28(mol)\)
- Giả sử chỉ có \(Mg\)phản ứng, Al chưa phản ứng
PTHH: Mg + 2HCl → MgCl2 + H2↑
⟹ nMg = nH2 = 0,28 (mol)
⟹ mMg = 0,28.24 = 6,72 (g)
⟹ Khối lượng kim loại còn lại là: mKL = 8 - 6,72 = 1,28 (g) # 2,36 (g) ⟹ loại.
- Giả sử có cả Mg và Al đều phản ứng. Do Mg là kim loại hoạt động mạnh hơn Al nên Mg pư hết trước, sau đó mới đến Al pư.
⟹ Chất rắn còn dư là Al
mMg + mAl pu = 8 - 2,36 = 5,64 (g)
Đặt nMg = x (mol); nAl pư = y (mol)
PTHH: Mg + 2HCl → MgCl2 + H2↑
(mol) x → x
2Al + 6HCl → AlCl3 + 3H2↑
(mol) y → 1,5y
Theo bài ra ta có hệ phương trình sau:
\(\left\{ \begin{array}{l}\sum {{n_{{H_2}}} = \,} x + 1,5y = 0,28\\\sum {m{\,_{hh}} = \,} 24x + 27y = 5,64\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 0,1(mol) = {n_{Mg}}\\y = 0,12(mol) = {n_{Al\,pu}}\end{array} \right.\)
Phần trăm khối lượng mỗi kim loại có trong hỗn hợp là:
\(\left\{ \begin{array}{l}\% {m_{Mg}} = \frac{{{m_{Mg}}}}{{{m_{hh}}}}.100\% = \frac{{0,1.24}}{8}.100\% = 30\% \\\% {m_{Al}} = 100\% - 30\% = 70\% \end{array} \right.\)
Thêm 250 ml dung dịch NaOH 2M vào 200 ml dung dịch H3PO4 1,5M. Muối tạo thành và khối lượng tương ứng là:
-
A.
14,2 gam Na2HPO4; 32,8 gam Na3PO4
-
B.
28,4 gam Na2HPO4; 16,4 gam Na3PO4
-
C.
12,0 gam NaH2PO4; 28,4 gam Na2HPO4
-
D.
24,0 gam NaH2PO4; 14,2 gam Na2HPO4
Đáp án : C
Lập tỉ lệ \(k = \dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\)
PTHH có thể xảy ra:
NaOH + H3PO4 → NaH2PO4 + H2O (1)
2NaOH + H3PO4 → Na2HPO4 + 2H2O (2)
3NaOH + H3PO4 → Na3PO4 + 3H2O (3)
Nếu k ≤ 1 chỉ xảy ra (1)
Nếu 1 < k < 2 xảy ra cả (1); (2)
Nếu 2 < k < 3 xảy ra của (2); (3)
Nếu k ≥ 3 xảy ra (3)
Nếu k = 2 thì chỉ xảy ra (2)
Sau khi xác định được phản ứng xảy ra theo phương trình nào thì dựa vào phương trình đó để giải bài toán.
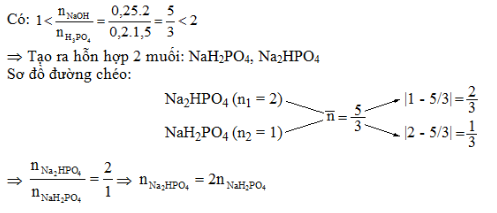
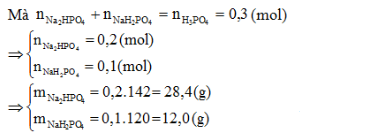
Thành phần phần trăm của Na và Ca trong hợp chất NaOH và Ca(OH)2 lần lượt là:
-
A.
50% và 54%
-
B.
52% và 56%
-
C.
54,1% và 57,5%
-
D.
57,5% và 54,1%
Đáp án : D
Công thức tính phần trăm khối lượng của nguyên tố trong hợp chất:
$\% {m_R} = \frac{{n.{M_R}}}{{{M_{hop\,\,chat}}}}.100\% $ với n là số nguyên tử R có trong 1 phân tử hợp chất đó
Công thức tính phần trăm khối lượng của nguyên tố trong hợp chất:
$\% {m_R} = \frac{{n.{M_R}}}{{{M_{hop\,\,chat}}}}.100\% $ với n là số nguyên tử R có trong 1 phân tử hợp chất đó
Ta có: $\% {m_{Na}} = \frac{{{M_{Na}}}}{{{M_{NaOH}}}}.100\% = \frac{{23}}{{40}}.100\% = 57,5\% $
$\% {m_{Ca}} = \frac{{{M_{Ca}}}}{{{M_{Ca{{(OH)}_2}}}}}.100\% = \frac{{40}}{{74}}.100\% = 54,1\% $
Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
-
A.
29,58% và 70,42%
-
B.
70,42% và 29,58%
-
C.
65% và 35%
-
D.
35% và 65%
Đáp án : B
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y => mhỗn hợp = PT(1)
Phương trình hóa học:
CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
x mol → x mol
MgCO3 $\xrightarrow{{{t^o}}}$ MgO + CO2
y mol → y mol
$ = > {n_{C{O_2}}} = PT(2)$
${n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15\,\,mol$
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y mol
=> mhỗn hợp = 100x + 84y = 14,2 (1)
Phương trình hóa học:
CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2
x mol → x mol
MgCO3 $\xrightarrow{{{t^o}}}$ MgO + CO2
y mol → y mol
$ = > {n_{C{O_2}}} = x + y = 0,15\,\,mol\,\,(2)$
Từ (1) và (2) => x = 0,1 mol; y = 0,05 mol
$ = > \% {m_{CaC{{\text{O}}_3}}} = \frac{{100.0,1}}{{14,2}}.100\% = 70,42\% ;\,\,\% {m_{MgC{O_3}}} = 29,58\% $
Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
-
A.
2,24 lít
-
B.
4,48 lít
-
C.
22,4 lít
-
D.
44,8 lít
Đáp án : B
PTHH: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
Tỉ lê: 1 2
Pứ: 0,1 ? mol
Từ PTHH ta có n NH3 = 2 n Ba(OH)2 = 0,2 mol
=> V NH3 = n NH3 . 22,4 = 0,2 . 22,4 = 44,8 lít
Khi làm nguội 1026,4 gam dung dịch bão hòa R2SO4. nH2O (trong đó R là kim loại kiềm và n nguyên, thỏa mãn điều kiện 7< n< 12) từ 800C xuống 100C thì có 395,4 gam tinh thể R2SO4. nH2O tách ra khỏi dung dịch. Biết độ tan của R2SO4 ở 800C và 100C lần lượt là 28,3 gam và 9 gam. Công thức phân tử của hiđrat nói trên là:
-
A.
Cu
-
B.
Na
-
C.
Al
-
D.
K
Đáp án : B
Phương pháp :
- Một chất có độ tan S thì m của chất tan là: \(\begin{array}{l}{m_{ct}}\, = \,\frac{{{m_{dd}}}}{{100 + S}}.S\\\end{array}\), ta tính được:
+ Tính khối lượng R2SO4 ở 800C → Khối lượng dd R2SO4 ở 100C
+ Tính khối lượng R2SO4 ở 100C
- Tính khối lượng H2O: \({m_{{H_2}O}}\, = \,{m_{tinh\,the\,{R_2}S{O_4}}}\, - \,{m_{{R_2}S{O_4}\,({{10}^o}C)}}\) => \({n_{{H_2}O}}\)
- Tính số mol R2SO4 : \({n_{{R_2}S{O_4}}}\, = \,{n_{{H_2}O}}:n\) mol
- Với 7 <n< 12 => Biện luận tìm n và R
=> CTPT của hiđrat
Độ tan của R2SO4 ở 800C là 28,3 gam
→ trong 1026,4 g dd có: \({m_{{R_2}S{O_4}\,}} = \,\,\frac{{1026,4}}{{100 + 28,3}}.28,3 = \,226,4(g)\)
Khi làm lạnh thì mdd =1026,4 -395,4= 631g
→ dd có: \({m_{{R_2}S{O_4}({{10}^o}C)}}\,\, = \,\,\frac{{631}}{{100 + 9}}.9\, = \,52,1g\)
Ta có: \({m_{{R_2}S{O_4}(tinh{\text{ }}thể)}} = 226,4{\text{ }}-{\text{ }}52,1{\text{ }} = {\text{ }}174,3g\)
→ \({m_{{H_2}O}}\, = \,395,4\, - \,174,3\, = \,221,1g\ → \({n_{{H_2}O}}{\mkern 1mu} = {\mkern 1mu} \,\frac{{737}}{{60}}mol\)
→ \({n_{{R_2}S{O_4}}}\, = \frac{{737}}{{60n}} \to {M_{{R_2}S{O_4}}} = 2R + 96 = \frac{{174,3}}{{{n_{{R_2}S{O_4}}}}} = 14,19n\)
Với 7 <n< 12 thỏa mãn n=10 và R =23
Vậy CTPT của hiđrat là: Na2SO4.10H2O
Một loại phân dùng để bón cho cây được một người sử dụng với khối lượng là 500 gam, phân này có thành phần hóa học là (NH4)2SO4. Cho các phát biểu sau về loại phân bón trên:
(1) Loại phân này được người đó sử dụng nhằm cung cấp đạm và lân cho cây.
(2) Thành phần phần trăm nguyên tố dinh dưỡng có trong 200 gam phân bón trên là 21,21%
(3) Khối lượng của nguyên tố dinh dưỡng có trong 500 gam phân bón trên là 106,06 gam.
(4) Loại phân này khi hòa tan vào nước thì chỉ thấy một phần nhỏ phân bị tan ra, phần còn lại ở dạng rắn dẻo.
(5) Nếu thay 500 gam phân urê bằng 500 gam phân bón trên thì sẽ có lợi hơn.
Số phát biểu đúng là
-
A.
5
-
B.
4
-
C.
3
-
D.
2
Đáp án : D
Dựa vào kiến thức về phân bón hóa học được học ở SGK hóa 9 –trang 37 để trả lời
(1) Sai :(NH4)2SO4 chứa nguyên tố N nên dùng để cung cấp phân đạm cho cây, không chứa Photpho \( \to\) không dùng để cung cấp phân lân
(2) Đúng: Phần trăm khối lượng N có trong phân hóa học là: \(\% N = \dfrac{{{M_N}}}{{{M_{{{(N{H_4})}_2}S{O_4}}}}}.100\% = \dfrac{{14.2}}{{132}}.100\% = 21,21\% \)
(3) Đúng \({n_{{{(N{H_4})}_2}S{O_4}}} = \dfrac{{500}}{{132}}\,\,mol \to {n_N} = 2{n_{{{(N{H_4})}_2}S{O_4}}} = \dfrac{{250}}{{33}}\,\,mol \to {m_N} = \dfrac{{250}}{{33}}.14 = 106,06\,\,gam\)
(4) Sai vì phân này tan hoàn toàn trong nước
(5) Sai vì phân ure (NH2)2CO có hàm lượng N cao hơn phân (NH4)2SO4 \( \to\) thay ure bằng phân này sẽ giảm hàm lượng nguyên tố dinh dưỡng \( \to\) ít lợi hơn
Vậy có 2 phát biểu đúng
Biết khối lượng riêng của nhôm là 2,7g/cm3. Vậy thể tích 1 mol của nhôm là:
-
A.
2,7gam
-
B.
10cm3
-
C.
27gam
-
D.
100cm3
Đáp án : B
Công thức: mAl = nAl . MAl = ? (g)
Thể tích của Al: VAl = mAl : DAl = ? cm3
m Al = nAl . MAl = 1 . 27 = 27g
D = m : V => V = m : D = 27 : 2,7 = 10 cm3
Hòa tan 5,1g oxit của một kim loại hóa trị III bằng dung dịch HCl, số mol axit cần dùng là 0,3 mol. Công thức phân tử của oxit đó là :
-
A.
Fe2O3
-
B.
Al2O3
-
C.
Cr2O3
-
D.
FeO
Đáp án : B
Gọi công thức của oxit là A2O3
Ta có A2O3 + 6HCl → 2ACl3 + 3H2O
Từ pthh ta có nA2O3 = 1/6 nHCl = 1/6 . 0,3 = 0,05 mol
=> MA2O3 = mA2O3 : nA2O3 = ?
=> Phân tử khối của A
Gọi công thức của oxit là A2O3
Ta có A2O3 + 6HCl → 2ACl3 + 3H2O
Từ pthh ta có nA2O3 = 1/6 nHCl = 1/6 . 0,3 = 0,05 mol
=> MA2O3 = mA2O3 : nA2O3 = 5,1 : 0,05 = 102
MA2O3 = 2 . MA + 3 . 16 = 2MA + 48 = 102
=> MA = 27 => A là nhôm
Cho 5,4 gam bột nhôm vào 200 ml dung dịch NaOH, sau phản ứng thấy khối lượng dung dịch tăng 3,6 gam. Nồng độ mol/lít của dung dịch NaOH là
-
A.
0,45M.
-
B.
1,00M.
-
C.
0,75M.
-
D.
0,50M.
Đáp án : C
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
x → x → 1,5x
+) Khối lượng dung dịch tăng 3,6 gam => ∆mtăng = mAl – mH2 = 3,6 gam
+) nNaOH = nAl phản ứng
nAl = 0,2 mol
Gọi số mol Al phản ứng là x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
x → x → 1,5x
Khối lượng dung dịch tăng 3,6 gam => ∆mtăng = mAl – mH2 = 3,6 gam
=> 27x – 1,5x.2 = 3,6 => x = 0,15 mol
Theo PT: nNaOH = nAl phản ứng = 0,15 mol
$ = > {C_{M\,\,NaOH}} = \frac{{0,15}}{{0,2}} = 0,75M$
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong X là
-
A.
0,3 mol.
-
B.
0,6 mol.
-
C.
0,4 mol.
-
D.
0,25 mol.
Đáp án : A
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2 mol ← 0,3 mol
2Al + 6HCl → AlCl3 + 3H2
0,2 mol → 0,3 mol
Fe + 2HCl → FeCl2 + H2
0,1 mol ← 0,1 mol
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 mol ← 0,1 mol
Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2 => trong Y chứa Al dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,2 mol ← 0,3 mol
=> nAl dư = 0,2 mol
Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2
2Al + 6HCl → AlCl3 + 3H2
0,2 mol → 0,3 mol
Fe + 2HCl → FeCl2 + H2
0,1 mol ← 0,1 mol
Phản ứng nhiệt nhôm:
2Al + Fe2O3 → Al2O3 + 2Fe
0,1 mol ← 0,1 mol
=> ∑nAl ban đầu = nAl dư + nAl phản ứng = 0,2 + 0,1 = 0,3 mol
Cho 11,2 gam kim loại sắt tác dụng hết với dd H2SO4 loãng, thể tích khí H2 thu được ở đktc là
-
A.
2,24 lít.
-
B.
3,36 lít.
-
C.
6,72 lít.
-
D.
4,48 lít.
Đáp án : D
+ nFe = mFe/MFe.
+ Fe + H2SO4 à FeSO4 + H2
+ Theo PTHH thì: nH2 = nFe => VH2 = 22,4. nH2
+ nFe = mFe/MFe = 11,2/56 = 0,2 mol.
+ Fe + H2SO4 → FeSO4 + H2
+ Theo PTHH thì nH2 = nFe ⟹ VH2 = 22,4. nH2 = 22,4.0,2 = 4,48 lít
Cho dung dịch AgNO3 dư tác dụng với hỗn hợp có hòa tan 12,5 gam hai muối KCl và KBr thu được 20,78 gam hỗn hợp AgCl và AgBr. Thành phần % của muối AgCl trong hỗn hợp thu được sau phản ứng là.
-
A.
76,22%
-
B.
67,26%
-
C.
22,67%
-
D.
27,62%
Đáp án : D

Hòa tan 7,74 gam hỗn hợp 2 kim loại Mg, Al trong 500ml dung dịch hỗn hợp chứa HCl 1M và H2SO4 0,38M loãng. Thu được dung dịch A và 8,736 lít khí H2 (đktc). Khối lượng muối có trong dung dịch A là
-
A.
38 gam
-
B.
40 gam
-
C.
42 gam
-
D.
36 gam
Đáp án : B
So sánh số mol H có trong tổng HCl và H2SO4 với số mol H có trong H2 từ đó rút được axit pư dư, kim loại phản ứng hết
TH1: giả sử HCl phản ứng hết, H2SO4 dư
Tính được: mmuối 1 = mKL + mHCl + mH2SO4 pư - mH2 = ?
TH2: giả sử H2SO4 phản ứng hết, HCl dư
Tính được mmuối 2 = mKL + mHCl pư + mH2SO4 - mH2 = ?
Vì thực tế phản ứng xảy ra đồng thời nên cả 2 axit đều dư
Vì thực tế phản ứng xảy ra đồng thời nên 2 axit cùng dư sau phản ứng
⟹ mmuối 1 < mmuối A < mmuối 2
PTHH: Mg + 2HCl → MgCl2 + H2↑ (1)
2Al + 6HCl → 2AlCl3 + 3H2↑ (2)
Mg + H2SO4 → MgSO4 + H2↑ (3)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (4)
500 ml = 0,5 (lít)
\(\left. \begin{array}{l} \Rightarrow {n_{HCl}} = 0,5.1 = 0,5\,(mol)\\ \Rightarrow {n_{{H_2}S{O_4}}} = 0,5.0,38 = 0,19\,(mol)\end{array} \right\} \Rightarrow {n_H} = {n_{HCl}} + 2{n_{H2SO4}} = 0,5 + 2.0,19 = 0,88\,(mol)\)
nH2(đktc) = 8,736/22,4 = 0,39 (mol) ⟹ nH = 2nH2 = 2.0,39 = 0,78 (mol)
Ta thấy: 0,88 > 0,78 nên axit dư, kim loại phản ứng hết.
TH1: giả sử HCl phản ứng hết, H2SO4 dư
nHCl = 0,5 (mol) ⟹ nH2 (1)+(2) = 1/2nHCl = 1/2.0,5 = 0,25 (mol)
⟹ nH2 (3)+(4) = 0,39 - 0,25 = 0,14 (mol) ⟹ nH2SO4 pư = 0,14 (mol)
Theo ĐL BTKL ta có:
mmuối = mKL + mHCl + mH2SO4 pư - mH2 = 7,74 + 0,5.36,5 + 0,14.98 - 0,39.2 = 38,93 (g)
TH2: giả sử H2SO4 phản ứng hết, HCl dư
nH2SO4 = 0,19 (mol) ⟹ nH2(3)+(4) = 0,19 (mol)
⟹ nH2(1)+(2) = 0,39 - 0,19 = 0,2 (mol) ⟹ nHCl pư = 2.0,2 = 0,4 (mol)
Theo ĐLBTKL ta có: mmuối = mKL + mHCl pư + mH2SO4 - mH2 = 7,74 + 0,4.36,5 + 0,19.98 - 0,39.2 = 40,18 (g)
Vì thực tế phản ứng xảy ra đồng thời nên cả 2 axit đều dư
Suy ra tổng khối lượng muối A thu được là: 38,93 (g) < mmuối A < 40,18 (g)
Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
-
A.
Kim loại R không tan được trong nước ở điều kiện thường.
-
B.
Kim loại R khi phản ứng với lưu huỳnh sẽ tạo ra chất rắn có màu đen.
-
C.
Giá trị của V là 1,12.
-
D.
Thành phần phần trăm về khối lượng của R (hóa trị II) trong hợp chất muối sunfat ứng với R là 28%.
Đáp án : D
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
R + 2HCl → RCl2 + H2↑ (2)
Trong hỗn hợp ban đầu \({n_{{H_2}S{O_4}}}:{n_{HCl}} = 1:1 \to \) phản ứng với R theo tỉ lệ 1: 1
\( \to\) Tỉ lệ của H2SO4 dư và HCl dư cũng là 1: 1
Đặt số mol H2SO4 dư = số mol HCl dư = x (mol)
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
x →2x (mol)
HCl + KOH → KCl + H2O (4)
x → x (mol)
\( \to\) tổng số mol KOH là: 2x + x = 0,02 \( \to\) x = ? (mol)
Từ đó tính được số mol H2SO4; HCl pư ở (1), (2). Đặt vào phương trình (1), (2) tính toán được các dữ liệu mà đề bài yêu cầu.
\({n_{{H_2}S{O_4}}} = 0,5.0,08 = 0,04\,\,mol\) ; nHCl = 0,2.0,2 = 0,04 (mol); nKOH = 0,1.0,2 = 0,02 (mol)
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
R + 2HCl → RCl2+ H2↑ (2)
Trong hỗn hợp ban đầu \({n_{{H_2}S{O_4}}}:{n_{HCl}} = 0,04:0,04 = 1:1 \to \) phản ứng với R theo tỉ lệ 1: 1
\( \to\) Tỉ lệ của H2SO4 dư và HCl dư cũng là 1: 1
Đặt số mol H2SO4 dư = số mol HCl dư = x (mol)
H2SO4 + 2KOH → K2SO4 + 2H2O (3)
x →2x (mol)
HCl + KOH → KCl + H2O (4)
x → x (mol)
\( \to\) tổng số mol KOH là: 2x + x = 0,02
\( \to\) x = \(\dfrac{1}{{150}}\) (mol)
\( \to\) \({n_{{H_2}S{O_4}(1)}} = 0,04 - \dfrac{1}{{150}} = \dfrac{1}{{30}}\) (mol)
nHCl(1) = 0,04 – \(\dfrac{1}{{150}}\) = \(\dfrac{1}{{30}}\) (mol)
PTHH:
R + H2SO4 → RSO4 + H2↑ (1)
\({1 \over {30}} \leftarrow {1 \over {30}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to {1 \over {30}}\)
R + 2HCl → RCl2 + H2↑ (2)
\({1 \over {60}} \leftarrow {1 \over {30}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to {1 \over {60}}\)
\( \Rightarrow \sum {{n_{{H_2}}} = {1 \over {30}}} + {1 \over {60}} = 0,05\,(mol) \Rightarrow {V_{{H_2}}}(dktc) = 0,05 \times 22,4 = 1,12(l)\) => C đúng
\( \Rightarrow \sum {{n_R} = {1 \over {30}}} + {1 \over {60}} = 0,05\,(mol) \Rightarrow {M_R} = {{{m_R}} \over {{n_R}}} = {{2,8} \over {0,05}} = 56\,(Fe)\) => A,B đúng
\(\% Fe = {{{m_{Fe}}} \over {{m_{FeS{O_4}}}}}.100\% = {{{1 \over {30}} \times 56} \over {{1 \over {30}} \times 152}}.100\% = 36,84\% \) => D sai
Tiến hành hai thí nghiệm:
-Thí nghiệm 1: Cho 650 ml dung dịch NaOH 2M vào 400 ml dung dịch AlCl3 aM thu được 3b gam kết tủa.
-Thí nghiệm 2: Cho 700 ml dung dịch NaOH 2M vào 400 ml dung dịch AlCl3 aM thu được 2b gam kết tủa.
Giá trị của a, b là:
-
A.
a=1(M); b = 15,6(g)
-
B.
a=2(M); b = 7,8(g)
-
C.
a=2(M); b = 15,6(g)
-
D.
a=1(M); b = 7,8(g)
Đáp án : D
3NaOH + AlCl3 → Al(OH)3+ 3NaCl (1)
Có thể có: NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
nNaOH (TN1) = 0,65.2=1,3(mol)
nNaOH (TN2) = 0,7.2=1,4(mol)
nNaOH (TN1) = 1,3<nNaOH (TN2) = 1,4; lượng AlCl3 là như nhau;
mà \({m_{Al{{(OH)}_3}(TN1)}} = 3b > {m_{Al{{(OH)}_3}(TN2)}} = 2b\)
Nên xảy ra 2 trường hợp sau:
Trường hợp 1: Ở thí nghiệm 1 chỉ xảy ra pư (1): NaOH hết, AlCl3 dư.
Ở thí nghiệm 2 xảy ra 2 pư (1), (2): kết tủa Al(OH)3 tan một phần.
Trường hợp 2: Cả 2 thí nghiệm kết tủa Al(OH)3 đều tan một phần.
3NaOH + AlCl3 → Al(OH)3+ 3NaCl (1)
Có thể có: NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
nNaOH (TN1) = 0,65.2=1,3(mol)
nNaOH (TN2) = 0,7.2=1,4(mol)
nNaOH (TN1) = 1,3<nNaOH (TN2) = 1,4; lượng AlCl3 là như nhau;
mà \({m_{Al{{(OH)}_3}(TN1)}} = 3b > {m_{Al{{(OH)}_3}(TN2)}} = 2b\)
Nên xảy ra 2 trường hợp sau:
Trường hợp 1: Ở thí nghiệm 1 chỉ xảy ra pư (1): NaOH hết, AlCl3 dư.
Ở thí nghiệm 2 xảy ra 2 pư (1), (2): kết tủa Al(OH)3 tan một phần.
+ Xét TN1: \({n_{NaOH}} = 3{n_{Al{{(OH)}_3}}} \to 3.\frac{{3b}}{{78}} = 1,3 \to b = \frac{{169}}{{15}}\)
+ Xét TN2:
Theo (1): \({n_{NaOH}} = 3{n_{AlC{l_3}}} = 3.0,4a = 1,2a\)
Theo (2): \({n_{NaOH}} = {n_{Al{{(OH)}_3}}} = 0,4a - \frac{{2b}}{{78}} \to 1,2a + 0,4a - \frac{{2b}}{{78}} = 1,4\)
→ a= 19/18
Ta thấy: \({n_{AlC{l_3}}} = 0,4a = 0,422(mol);{n_{Al{{(OH)}_3}}} = \frac{{3b}}{{78}} = 0,433(mol) > {n_{AlC{l_3}}} = 0,422(mol)\) → Loại
Trường hợp 2: Cả 2 thí nghiệm kết tủa Al(OH)3 đều tan một phần.
+ Xét TN1:
\(\begin{gathered}
{n_{NaOH(1)}} = 1,2a(mol) \hfill \\
{n_{NaOH(2)}} = {n_{Al{{(OH)}_3}}} = 0,4a - \frac{{3b}}{{78}} \to 1,2a + 0,4a - \frac{{3b}}{{78}} = 1,3 \hfill \\
\to 1,6a - \frac{{3b}}{{78}} = 1,3(I) \hfill \\
\end{gathered} \)
+ Xét TN2:
Theo (1): \({n_{NaOH}} = 3{n_{AlC{l_3}}} = 3.0,4a = 1,2a\)
Theo (2): \({n_{NaOH}} = {n_{Al{{(OH)}_3}}} = 0,4a - \frac{{2b}}{{78}} \to 1,2a + 0,4a - \frac{{2b}}{{78}} = 1,4\)
\( \to 1,6a - \frac{{2b}}{{78}} = 1,4(II)\)
Giải (I), (II) ta được a=1(M); b = 7,8(g)

















